Die Interaktion von Actiniden mit biomolekularen Grenzflächen
Bei den Actiniden handelt es sich durchweg um radioaktive Schwermetalle. Während viele andere Metalle und Schwermetalle auf Grund ihrer stoffwechselphysiologischen Bedeutung für Organismen lebensnotwendig sind (z.B. Na, Mg, Cr, Fe, Co, Mo, Se), besitzen Actinide keine bekannte biologische Funktion (siehe Abb.1).
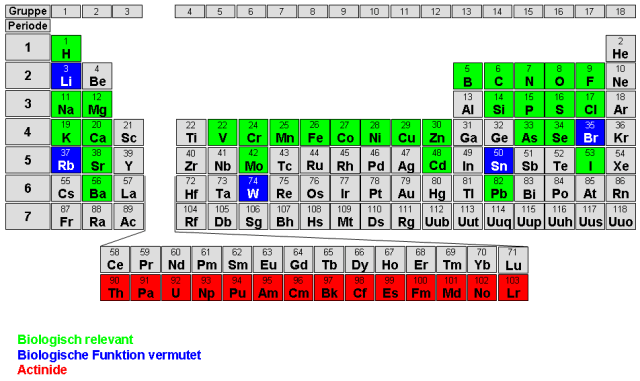
Abb. 1: Periodensystem der Elemente.
Dennoch können diese über chemische und biologische Prozesse, die ursprünglich der Versorgung mit lebensnotwendigen Elementen dienen, oder über eine direkte Schädigung der Zellwand in den Organismus gelangen. Diese Prozesse finden alle an biomolekularen Grenzflächen statt, das heißt an der Fläche zwischen einer Zelle oder einem Zellverbund und dem umgebenden Medium. Ein Aufnahme kann über die Nahrungskette, über den Boden, das Wasser und die Luft erfolgen. Da gerade Actinide wegen ihrer Radioaktivität und ihrer Toxizität in Organismen, Organen und Zellen schwere Schäden verursachen können, ist die Erforschung ihrer Wechselwirkung mit biologischen Systemen von grundlegender Bedeutung für die Gesunderhaltung von Pflanzen, Tieren und des Menschen. Aus Untersuchungen der Wechselwirkung von anderen giftigen Elementen mit Zellen ist bekannt, dass Organismen verschiedene Strategien entwickelt haben, um schädliche Verbindungen entweder von der Zelle fern zu halten, nach dem Eindringen wieder auszuschleusen oder in ungiftige Verbindungen umzusetzen.
Am Institut für Radiochemie interessiert uns deshalb, wie und in welcher Weise Organismen mit den natürlich vorkommenden Actiniden Thorium und Uran sowie den weiteren Actiniden Neptunium, Plutonium, Americium und Curium wechsel wirken.
Wie schützen sich Bazillen vor den Actiniden?
Das Haldenisolat Lysinibacillus sphaericus JG-A12
Im Rahmen radioökologischer Arbeiten wurden aus der Uranabfallhalde "Haberland" nahe Johanngeorgenstadt in Sachsen verschiedene Vertreter der Gattung Bacillus und Lysinibacillus isoliert und ihre Wechselwirkung mit Uran und anderen Schwermetallen untersucht (Raff, J. & Selenska-Pobell, S. (2006). Nuclear Engineering International 51 (619) 34-36). Am besten erforscht wurde diesbezüglich das Isolat Lysinibacillus sphaericus JG-A12 (früher Bacillus sphaericus JG-A12, Ahmed et al. (2007) Int. J. Syst. Evol. Microbiol. 57, 1117-1125) der Bodenprobe A (pH 5 mit 5,1 µg U pro g Boden). Es handelt sich dabei um ein Gram-positives Bakterium, das in der Lage ist als Dauerform, den so genannten Sporen, auch widrige Lebensbedingungen zu überstehen. Im Verlauf der Arbeiten wurde ein neuartiges S-Layer-Protein (von engl.: surface-layer) entdeckt (siehe Abb.2)., das dem Isolat L. sphaericus JG-A12 ein Überleben in seinem ursprünglichen Habitat, der Uranabfallhalde erlaubt.

Abb. 2: (A) Rasterkraftmikroskopisches Bild einer L. sphaericus JG-A12 Zelle, (B) lichtmikroskopisches Bild isolierter S-Layer und (C) transmissionselektronenmikroskopisches Bild der S-Layer mit einer Rekonstruktion der Gitterstruktur (rechte obere Ecke).
S-Layer bilden eine parakristalline monomolekulare Proteinschicht auf vielen Bakterien und Archaeen und stellen die äußerste Barriere der Zelle gegenüber ihrer Umwelt dar. Sie haben die Fähigkeit zur Selbstassemblierung, das heißt, sie sind in der Lage nach deren Zerlegung in Monomere spontan aus eine Lösung oder an Grenz- und Oberflächen als hochgeordnete monomolekulare Schicht zu reassemblieren. Auf Grund ihrer Aufgabe als Grenzschicht zwischen Zellinnerem und Zelläußerem sowie ihrer weiten Verbreitung ist unbestritten, dass S-Layer eine zentrale Rolle bei der Wechselwirkung von Bakterien mit ihrer Umgebung spielen, dennoch ist ihre Funktion bei vielen Bakterien noch ungeklärt.
Uranbindung durch die S-Layer von L. sphaericus JG-A12
Im Falle von L. sphaericus JG-A12 scheint der S-Layer giftige Metalle wie z.B. Uran zu binden und so eine Schädigung der Zelle zu verhindern, und gleichzeitig lebensnotwendige passieren zu lassen. Hinweise darauf lieferten Bindungsexperimente und röntgenabsorptionsspektroskopische Analysen der Wechselwirkung des Proteins mit Uran. So bindet das Protein bis zu 20 mg Uran pro g Trockengewicht bei einem pH-Wert von 4,5 und weist im Vergleich zu dem S-Layer Protein seines nächsten Verwandten L. sphaericus NCTC 9602 sowie dem Referenzprotein Rinderserumalbumin bei abnehmender Urankonzentration von 100 bis 1 mg U pro l eine deutlich höhere Bindungsaffinität von bis zu 99,3 % des angebotenen Urans auf (Abb.3).
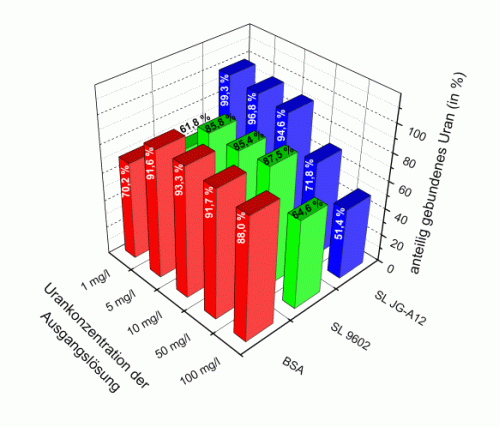
Abb. 3: Uranbindung durch die S-Layer von L. sphaericus JG-A12 (SL JG-A12) und L. sphaericus NCTC 9602 (SL 9602) sowie durch Rinderserumalbumin (BSA) bei pH 4,5.
Die röntgenabsorptionsspektroskopischen Untersuchungen der gebildeten Urankomplexe belegen außerdem, dass Uran bidentat von Carboxyl- und monodentat von Phosphatgruppen des S-Layer-Proteins gebunden wird (Merroun et al. (2005) Applied and Environmental Microbiology 71(9): 5532-5543). Ferner zeigen die Spektren, dass die Bindung des Urans an die S-Layer, die Sporen, und die bakterielle Zelle in gleicher Art und Weise erfolgt (siehe Abb.4).
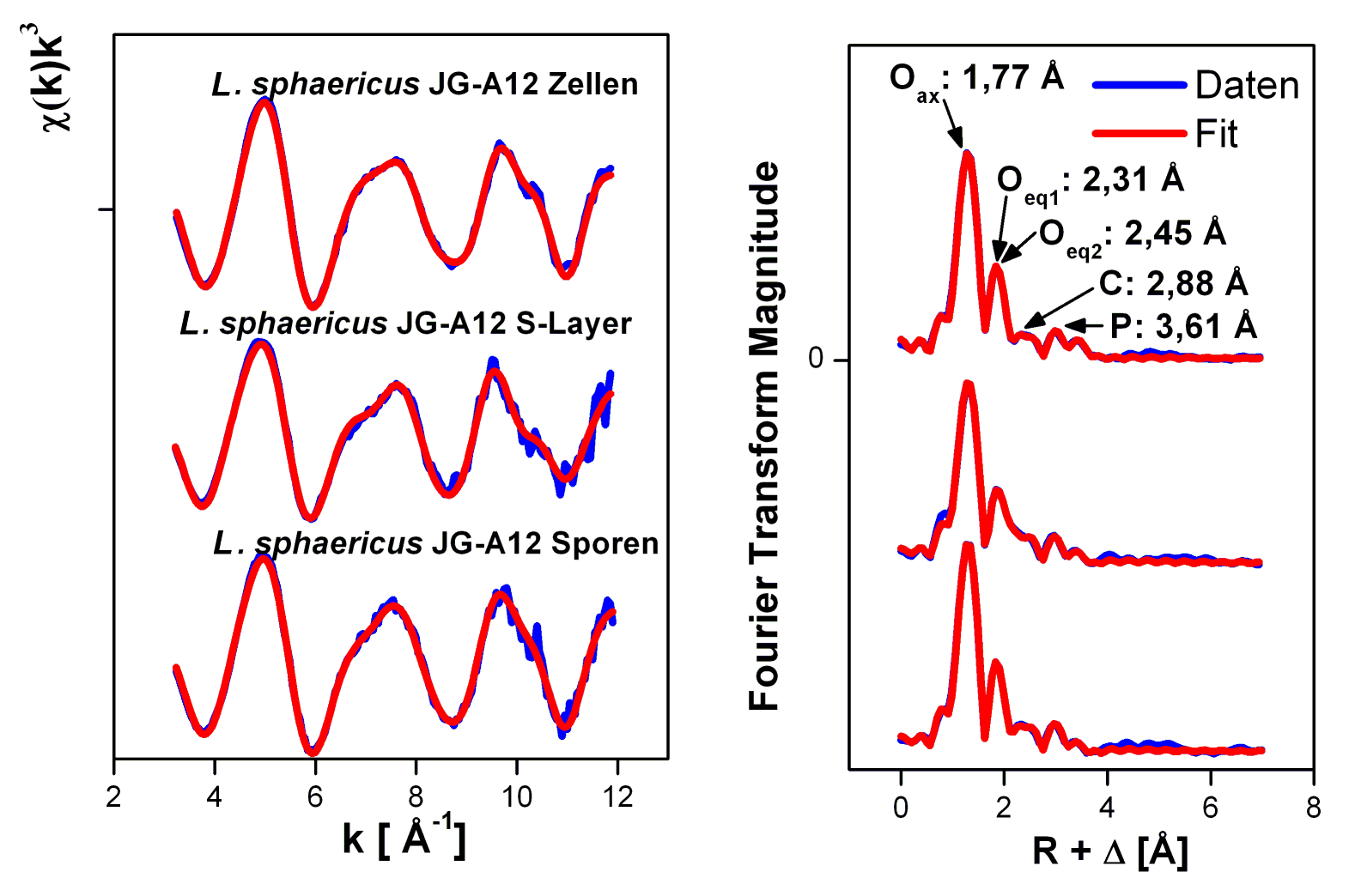
Abb. 4: EXAFS-Spektren (links) und die dazugehörigen Fourier transformierten Spektren (rechts) der Zellen, Sporen und S-Layer von L. sphaericus JG-A12.
Überraschenderweise besitzt das Hüllprotein posttranslationale Modifikationen, d.h. Modifikationen der Aminosäurenseitenketten die nach der Biosynthese des Proteins erfolgen, in Form von phosphorylierten Serin- und Threoninresten während die gängige Modifikation glykosylierter Aminosäuren fehlt. Eine Glykoslyierung von Proteinen bewirkt ihre Stabilisierung gegenüber Temperatur und proteolytischem Verdau, d.h. dem Abbau durch Enzyme, und kann eine Rolle bei der Proteinfaltung sowie bei der Oberflächenerkennung spielen. Demgegenüber dient die Phosphorylierung von Proteinen der Phosphatspeicherung, der Bindung, Speicherung und des Transports von Metallkationen, der Regulation von Enzymaktivitäten sowie der Vermittlung von Konformationsänderungen. S-Layer-Proteine von L. sphaericus JG-A12 enthalten ca. 1 mol Phosphat pro mol Protein, dies heißt, dass eine Aminosäure pro Proteinmonomer modifiziert ist. Außerdem befindet sich die Phosphorylierung in der Primärstruktur direkt im Anschluss an drei so genannte S-Layer homologe (SLH) Domänen, welche der Verankerung des Proteins in der Zellwand dienen. Aus diesem Grund vermuten wir, dass die Phosphorylierung eher eine regulatorische Rolle bei der Bindung von Uran spielt, als für die Immobilisierung großer Mengen von Uran verantwortlich ist. In weitergehenden Experimenten soll diese Arbeitshypothese überprüft werden.
Weitere Bacillus und Lysinibacillus Isolate
Weitere Isolate wurden aus einer fünffach höher mit Uran kontaminierten Bodenprobe (Probe B, pH 4 mit 23,7 µg U pro g Boden) der Haberlandhalde isoliert. Es handelt sich u.a. um die Bacillus sp. Isolate JG-B5T, B12, B35, B37, B 41, B53, B58 und B62 sowie um das Lysinibacillus sp. Isolat B7. Die S-Layer-Proteine dieser Bakterien weisen mit bis zu 411,7 mg U pro g Protein bei pH 4,5 weitaus höhere Bindungskapazitäten für Uran auf und sind soweit bislang untersucht phosphoryliert und glykosyliert (B5T, B7, B12, B53, B58, B62). Darüber hinaus konnte gezeigt werden, dass die S-Layer mit Ausnahme auf die Isolate A12, B5T und B53 höhere Bindungskapazitäten aufweisen als die intakten Zellen (siehe Abb. 5).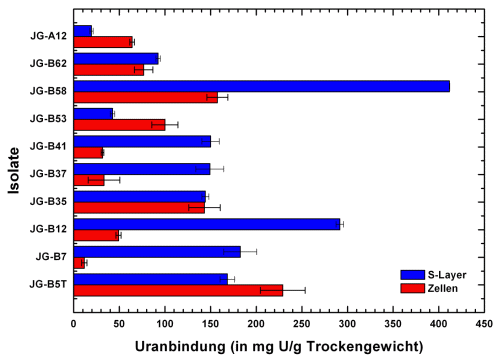
Abb. 5: Uranbindungskapazität verschiedener Bacillus und Lysinibacillus Haldenisolate und ihrer S-Layer bei pH 4,5
Diese Befunde sind äußerst überraschend und werden momentan in weiteren Experimenten eingehend untersucht. Erste Sequenzdaten und infrarotspektroskopische Analysen weisen darauf hin, dass die Anzahl der vorhandenen funktionellen Gruppen nicht für die Menge angebundenem Uran ausreichend ist und die Gitterstruktur der S-Layer eine größere Rolle bei der Uranbindung zu spielen scheint, als bislang angenommen. Bindungsexperimente bei höheren pH-Werten belegen außerdem die hervorragenden Uranbindungseigenschaften der S-Layer im Vergleich zu den Zellen bei neutralen pH-Werten.
In jedem Fall besitzen S-Layer-Proteine auf Grund ihrer Fähigkeit zur Selbstassemblierung, ihrer regelmäßigen Gitterstruktur mit Poren definierten Größe und Anordnung, den zahlreichen regelmäßig verteilten funktionellen Gruppen und ihrer Metall bindenden Eigenschaften ein enormes Potenzial für technische Anwendungen.
S-Layer mit hoher Metallbindungskapazität bilden den Ausgangspunkt für die Entwicklung Metall selektiver Filter
Die hohe Uranbindungskapazität verschiedener S-Layer hat zur Idee geführt, diese zur Herstellung intelligenter, Metall selektiver Filter zu verwenden (Raff, J., et al. (2003) Chemistry of Materials 15(1): 240-244). Wichtig dafür ist 1.) die selektive Metallbindung der S-Layer Proteine der Haldenisolate, die dazu führt, dass giftige Metalle nicht in die Zelle eindringen können, lebensnotwendige aber passieren können, 2.) die höhere chemische Stabilität der S-Layer von Bakterien aus extremen Standorten und 3.) die Fähigkeit aller S-Layer sich spontan an Grenz- und Oberflächen zu parakristallinen monomolekularen Schichten zu verbinden. Die Grundlagen der Idee sind in Abb. 6. schematisch dargestellt.
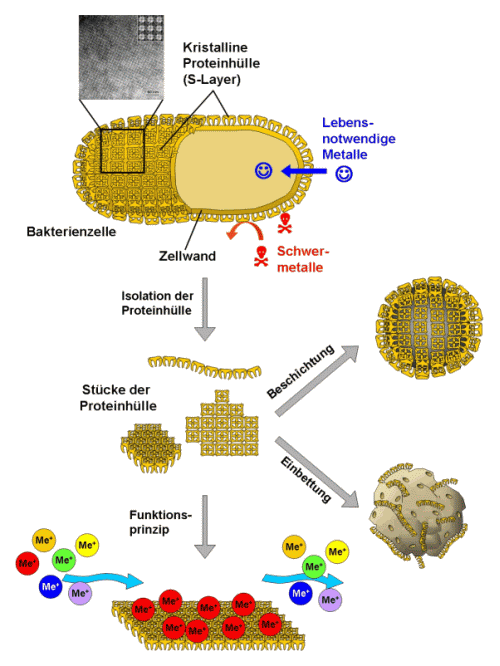
Abb. 6: Schema zur Nutzung bakterieller S-Layer als selektive Bindungsmatrix in Form von eingebetteter Biomasse oder als Beschichtung gängiger Filtermaterialien.
Neben der Verwendung isolierter S-Layer sollen zukünftig auch maßgeschneiderte S-Layer zur Bindung weiterer Metalle über chemische und molekularbiologische Modifikation der Proteine erzeugt werden. Ziel ist hier die Herstellung verschiedener Metall selektiver Filtermaterialien zur Entwicklung eines modular kombinierbaren Filtermaterialsystems, das - so unsere Zielvorstellung - eine individuelle Wasserbehandlung möglich machen soll.
Aufbauend auf die wissenschaftlichen Erkenntnisse wurde mit Unterstützung von LeibnizX sowie Dresden exists bereits ein Businessplan für die Gründungsidee BIOREM erarbeitet, der beim Businessplanwettbewerb Sachsen (futureSAX) in Phase I 2007 als beste Geschäftsidee in der Kategorie Bio- und Nanotechnologie ausgezeichnet wurde. Ziel der laufenden Arbeiten ist daher die konsequente Verfolgung des Technologietransfers und der Entwicklung eines marktreifen und marktgerechten Produkts für die Entfernung und Rückgewinnung von Metallen aus wässrigen Lösungen.
S-Layer: Schnittstelle von Bio- und Nanotechnologie
Neben der Bindung von Uran besitzen S-Layer weitere hochinteressante Eigenschaften, die für technische Anwendungen genutzt werden sollen. So organisieren sich die gereinigten S-Layer-Proteine zu hochgeordneten zweidimensionalen Gitterstrukturen mit, abhängig vom verwendeten Bakterienstamm, unterschiedlichen Symmetrien. Diese Gitterstrukturen umfassen regelmäßig angeordnete Poren von wenigen Nanometern Durchmesser. Solche Strukturen bieten eine ideale Matrix, um anorganische Nanopartikel definierter Größe herzustellen, die sich in ihrer Anordnung an der Gitterstruktur der S-Layer orientieren. Bei ihrer Herstellung macht man sich wiederum die außergewöhnlichen Metallbindungseigenschaften der S-Layer Proteine zunutze: Nach einer Anbindung von Metallsalzkomplexen werden diese durch die Zugabe eines Reduktionsmittels zum Metall umgesetzt. Abhängig vom Metall entstehen regelmäßig angeordnete Nanopartikel einer Größe von bis zu 5 nm. Auf diese einfache Art und Weise konnten bereits erfolgreich Pd, Pt und Au-Partikel hergestellt werden. Mittels Infrarot- und EXAFS-Spektroskopie konnte die Beteiligung von Carboxylgruppen an der Pd(II)-Bindung nachgewiesen werden (Fahmy et al. (2006), Biophysical Journal 91, 996-1007). Bei diesen Analysen wurde zudem eine außerordentliche pH-Stabilität der metallisierten S-Layer festgestellt, was eine wichtige Eigenschaft für ihre Verwendung in zukünftigen Anwendungen ist.
Da sich Nanopartikel in ihren physikalischen und chemischen Eigenschaften aufgrund ihres großen Oberflächen/Volumen Verhältnisses oft von makroskopischen Vergleichsmaterialien unterscheiden, sind sie von großem Interesse für technische Anwendungen. So weisen S-Layer produzierte Pd-Nanopartikel eine erhöhte katalytische Aktivität auf, was am Beispiel der Reduktion von Cr(VI) gezeigt werden konnte (Abb. 7). In Zusammenarbeit mit dem Hochfeld-Magnetlabor Dresden konnte zudem eine deutliche Verringerung der Suszeptibilität der Pd-Nanopartikel nachgewiesen werden (Herrmannsdörfer et al. (2007), Journal of Magnetism and Magnetic Materials 310, e821-e823).
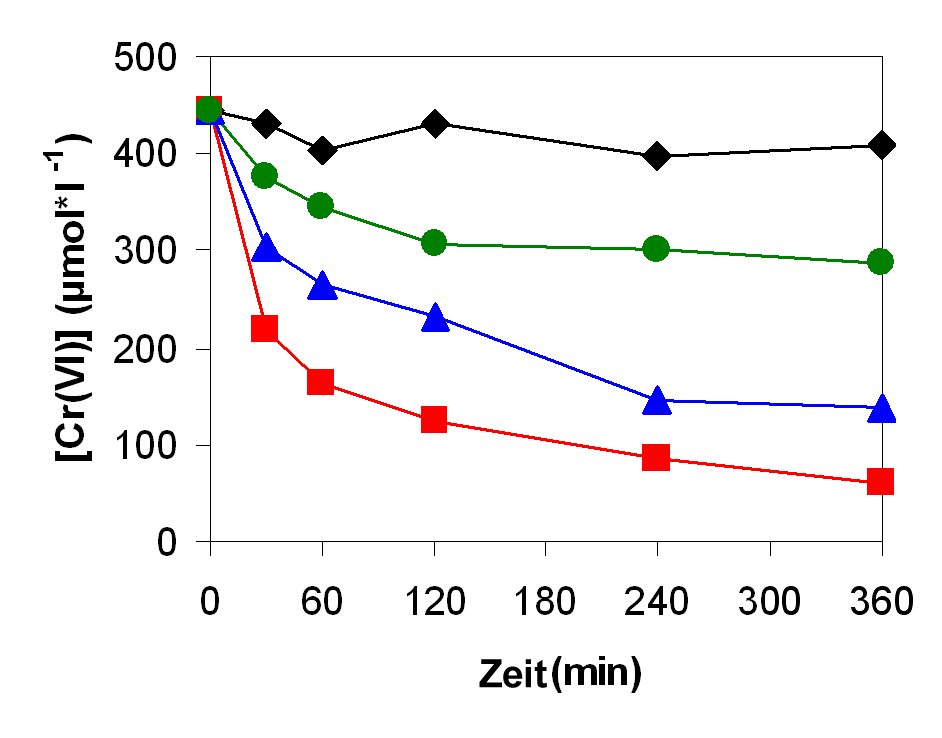
Abb. 7: Reduktion von 450 µM Cr(VI) mit 25 mM Natriumformat: ( ) ohne Katalysator, (
) ohne Katalysator, ( ) mit freiem Pd(0), (
) mit freiem Pd(0), ( ) mit 1 mg zellgebundenem Pd(0) (auf Zellen des Bakterienstammes Lysinibacillus sphaericus JG-A12), (
) mit 1 mg zellgebundenem Pd(0) (auf Zellen des Bakterienstammes Lysinibacillus sphaericus JG-A12), ( ) mit 1 mg S-layer-gebundenem Pd(0)
) mit 1 mg S-layer-gebundenem Pd(0)
Die hergestellten Hybridmaterialien, bestehend aus einem Proteinanteil und inorganischen Nanopartikeln, sind von besonderem Interesse für die Entwicklung von neuartigen Nanomaterialien und eröffnen eine Vielfalt von Möglichkeiten für ihre Verwendung auf unterschiedlichen Gebieten wie z.B. der Katalyse, Sensorik und Mikroelektronik
Ziel der laufenden Arbeiten ist eine Erweiterung des Spektrums der hergestellten Nanopartikel. In programmübergreifender Arbeit zusammen mit anderen Instituten des HZDR (Hochfeld-Magnet-Labor, Institut für Ionenstrahlphysik, Strahlenphysik) werden die strukturellen und physikalischen Eigenschaften der Nanopartikel sowie die Strukturdynamik der Proteine erforscht. Ein weiteres Ziel ist die Entwicklung von technischen Anwendungen für die hergestellten Hybridmaterialien.

