Präklinische Evaluierung von Radiokonjugaten
Gruppenmitglieder
- Dr. Wiebke Sihver ORCID
- Anne-Kathrin Nitt-Weber (biol.-techn. Assistenz)
Projekte und Ziele
|
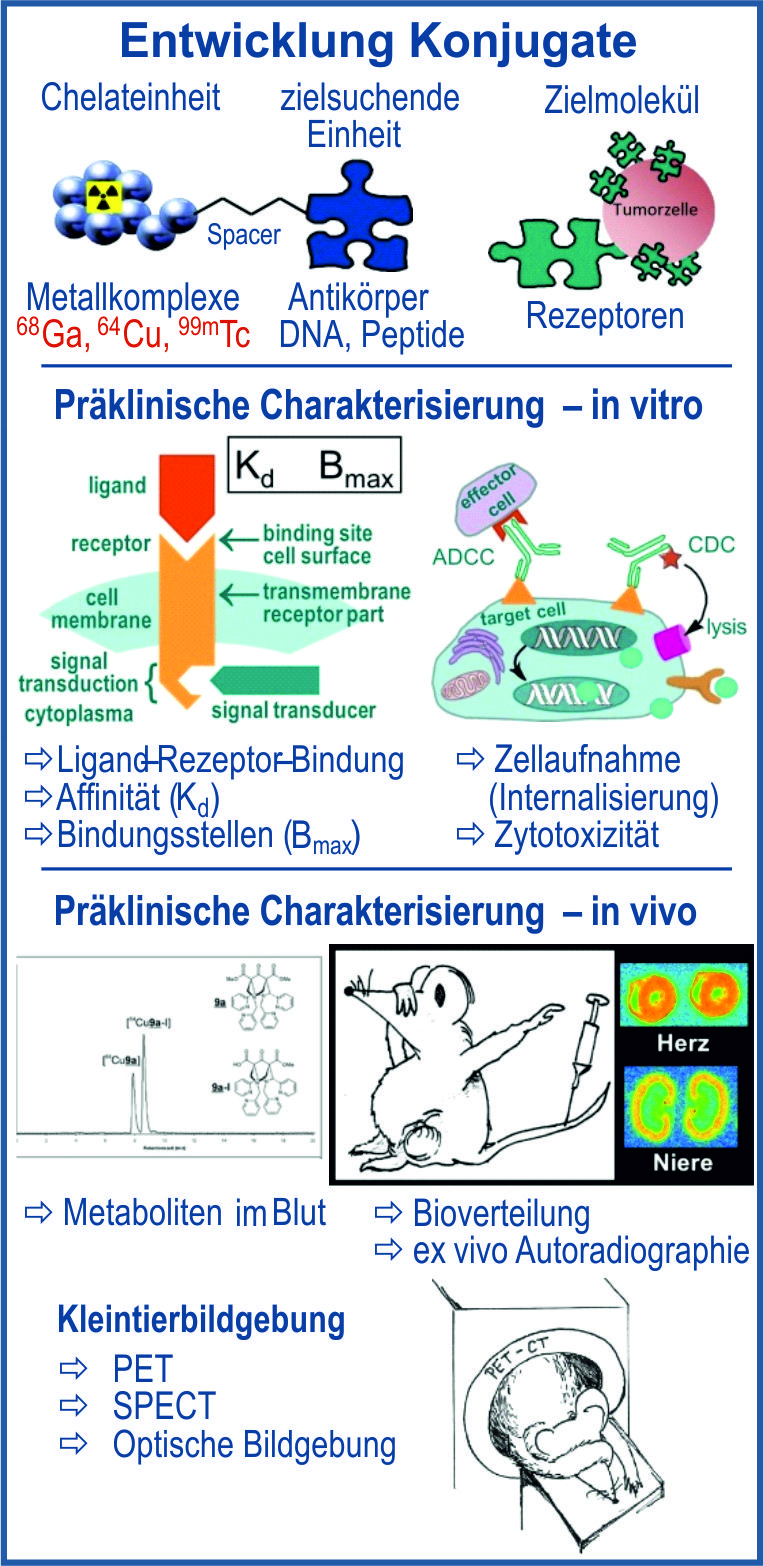
Präklinische Charakterisierung von Radiokonjugaten
Radiokonjugate sind zusammengesetzte Moleküle, die aus einem Bio(makro)molekül (beispielsweise Antikörper, Antikörperfragment, Nukleinsäure, Peptide bestehen und über angeknüpfte funktionelle Komplexbildner (bifunktionale Chelatoren) mit einem entsprechenden Radionuklid markiert sind. Je nach Auswahl des Radionuklids werden sie für diagnostische Zwecke zur Bildgebung mittels PET (68Ga, 18F, 64Cu) oder SPECT (99mTc, 111In) genutzt. Außerdem kommen für therapeutische Anwendungen auch längerlebige β--Emitter (90Y, 177Lu, 186Re) zum Einsatz. Bevor ein Radiokonjugat in ersten Humanuntersuchungen einsetzbar ist, durchläuft dieses eine umfangreiche präklinische Charakterisierung. Nach Etablierung einer zuverlässigen Analytik wird die Stabilität in physiologischen Lösungen, Medien und Seren getestet. In-vitro-Untersuchungen an Zelllinien oder Gewebepräparationen liefern Ergebnisse zur Bindungskinetik sowie Affinität an entsprechenden Zielstrukturen (Rezeptoren, Enzyme, Ionenkanäle), aber auch zur Gewebeaufnahme sowie zu physiologischen Veränderungen einschließlich Zelltoxizität. Weitere präklinische Studien werden in vivo am Kleintier (Maus, Ratte) durchgeführt. Die quantitative Aufnahme eines Radiokonjugates wird über die Bioverteilung bestimmt, wobei zusätzlich die Dosimetrie abgeschätzt werden kann. Blut und verschiedene Gewebe werden auf Metaboliten untersucht. Mittels Kleintierbildgebung (PET, SPECT, CT) wird die Akkumulation des Radioliganden in den relevanten Organen bzw. Geweben festgestellt. An dieser Stelle besteht großes Interesse, die Anzahl der Tierversuche zu minimieren. Die Einwerbung eines BMBF-Projektes zum Thema „Alternativmethoden zum Tierversuch“ wurde positiv bewertet. Das Projekt wird gefördert. Ein weiteres Projekt ist die präklinische Charakterisierung eines Anti-Prostata-Stammzell-Antigen (PSCA) Antiköper-Konjugates auf Grundlage der standardisierten Etablierung von Anti-EGFR-Antikörper Cetuximab-Konjugaten. Das erfolgt in enger Zusammenarbeit mit den Abteilungen für Radiopharmazeutische und Chemische Biologie, geleitet von Herrn Prof. Jens Pietzsch, sowie für Radioimmunologie, geleitet von Frau Dr. Anja Feldmann. Aktuelle Projekte
Referenzen
|
|
|
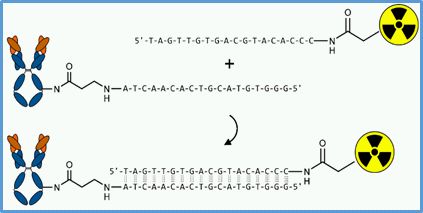
Darstellung von Tumoren mittels Pretargeting
Die beträchtliche Größe von Antikörpern verursacht eine nachteilige Pharmakokinetik, verbunden mit einer verlängerten Blutverweildauer und unspezifischen Gewebeanreicherungen. So induzieren radioaktiv-markierte Antikörper einen hohen Anteil der Strahlendosis, die nicht therapeutisch am Tumor wirkt, sondern hohe Strahlenbelastungen in kritischen Organen verursacht. Daher ist ein wirksames und hochspezifisches molekulares "Liefersystem" für zytotoxische Radionuklide erforderlich, um therapeutische Dosen an mit Antikörpern vorbehandelten Tumorzellen mit minimaler Strahlenexposition in gesundem Nachbargewebe zu erreichen. Das soll durch Trennung der Vorbehandlung (Pretargeting) und der Radiomarkierungsprozesse in vivo erfolgen. Abgeleitet vom effizienten Erkennungs- und Hybridisierungsprozess natürlicher komplementärer Nukleinsäuren, richtet sich der Fokus auf die Verwendung von oligomeren Peptidnukleinsäuren (PNAs) oder spiegelbildlichen L-konfigurierten DNA-Oligonukleotiden (L-ONs), welche die natürlichen Oligonukleotide perfekt bioorthogonal imitieren. Es wurde erfolgreich eine Methode zur Konjugation des Antikörpers Cetuximab mit unterschiedlicher Anzahl von PNAs oder L-ONs etabliert. Zwei ‘proof-of-principle’-Studien bestätigten das hohe Einsatzpotential von PNAs und L-ONs als Erkennungssystem in ‘Pretargeting‘-Ansätzen. Das Projekt wird weitergeführt unter Nutzung eines Antikörpers gegen das Prostata-Stammzell-Antigen (PSCA) in Zusammenarbeit mit der Abteilung für Radioimmunologie. Diese Methode hat möglicherweise das Potential in Kliniken ein vielseitiges diagnostisches und/oder therapeutisches Werkzeug mit einer breiten Palette verschiedener Anwendungen zu werden.
Publikationen
|
Prinzip der Anwendung von oligomeren PNAs oder gespiegelten L-ONs für Tumor-Pretargeting. Ein unmarkiertes, hochspezifisches Antikörper-L-ON-Konjugat wird in das Biosystem eingeführt und bekommt ausreichend Zeit sich am Tumor zu sammeln, bevor ein kleines radiomarkiertes komplementäres Oligonukleotid mit schneller Clearingrate verabreicht wird, um am vorlokalisiertem Antikörper-L-ON-Konjugat zu hybridisieren. |
|
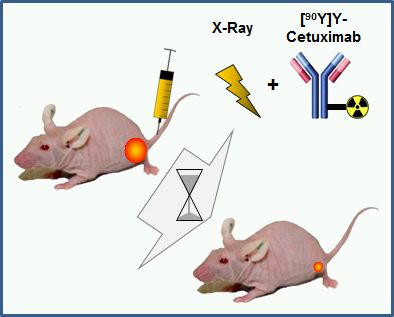
Kombination interner und externer Strahlentherapie (CIERT)
Die Kombination von interner (Partikel) und externer (Photonen, Partikel) Strahlentherapie ist eine vielversprechende Behandlungsstrategie, da sie potentiell Vorteile von beiden Modalitäten kombiniert, ohne dass sich die Toxizität erhöht. In enger Zusammenarbeit mit dem Institut für Radioonkologie – OncoRay unter Leitung von Frau Prof. Mechthild Krause konnte gezeigt werden, dass CIERT mit 90Y-markiertem Cetuximab die Tumorkontrollwahrscheinlichkeit eines Kopf- und Hals-Tumormodells (FaDu-Xenotransplantate) im Vergleich zu einer Einzeldosis in der externen oder internen Strahlentherapie massiv erhöhte. Weitere präklinische Studien sollen die Evaluierung verschiedener Radiotracer beinhalten, insbesondere solche mit kürzerer Eindringtiefe, dass mehr gesundes Gewebe erhalten bleibt. Eine wesentliche Voraussetzung für diese Untersuchungen ist die umfassende (radio-)chemische Charakterisierung der (radioaktiv markierten) Antikörper-Chelator-Konjugate. Dazu gehört die Erstellung von Protokollen, welche die Markierung des Antikörpers mit genau definierten Mengen an Aktivität ermöglichen. Publikationen
|
|
|
Interesse geweckt? Wir bieten jederzeit spannende Bachelor-/ Master-/ Diplomarbeiten an. Einfach e-mail schreiben und bewerben! |