Preclinical Evaluation of Radioconjugates
Projects and Aims
|
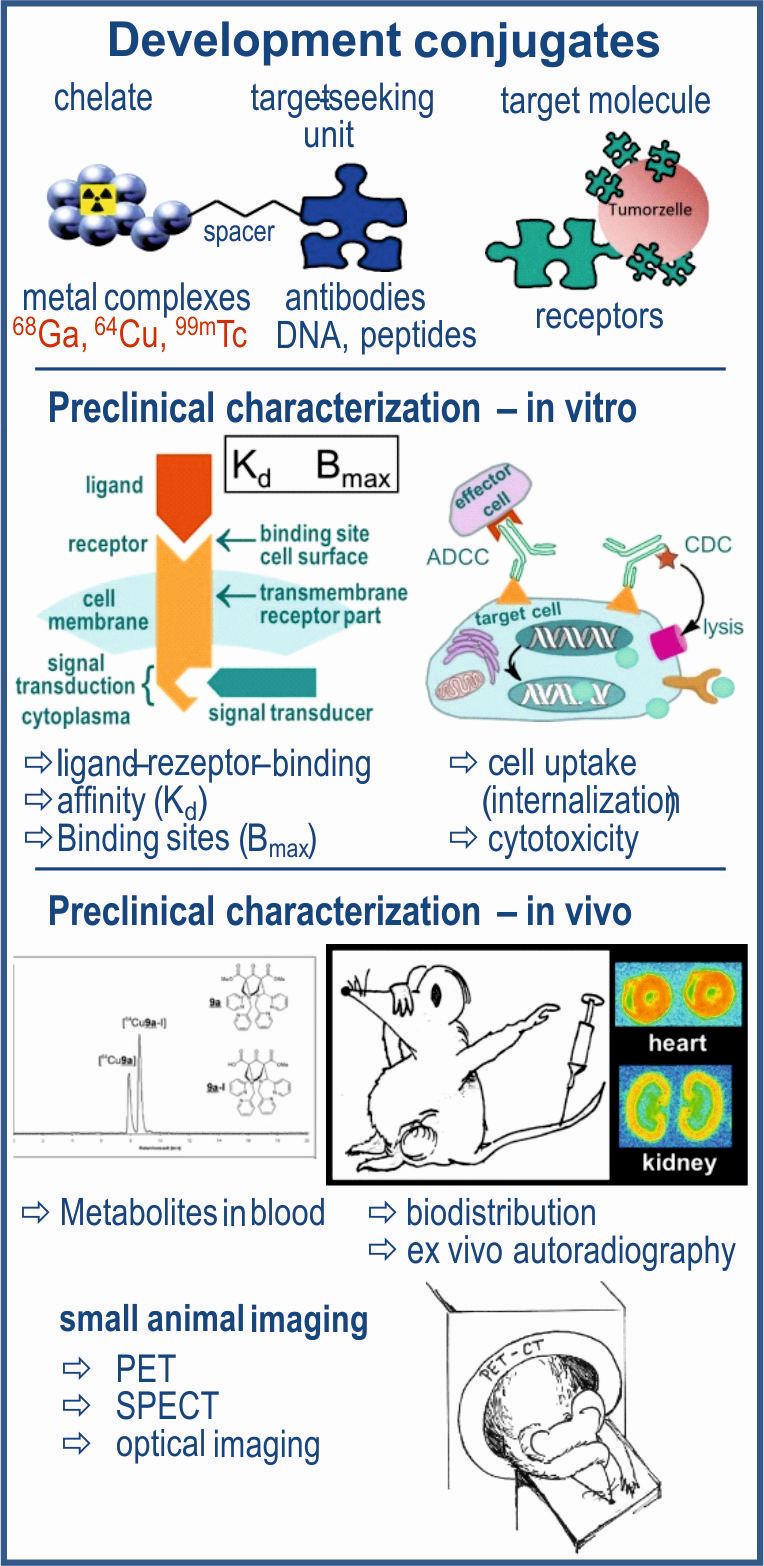
Preclinical Characterization of Radiokonjugates
Radioconjugates are large molecules (antibodies, antibody fragments, nucleic acids, peptides) which are labeled with an appropriated radionuclide via coupled functional molecules (bifunctional chelators). On the one hand, short-lived radionuclides (68Ga, 64Cu, 99mTc) are used for diagnostic purposes, PET and SPECT imaging, on the other hand longer lived β--emitters (90Y, 177Lu, 186Re) can be used for therapeutic applications. Before a radioconjugate can be applied in initial human examinations, this needs to pass a comprehensive preclinical characterization. After establishing of reliable analytical methods, the stability in physiological solutions, media und serum is tested. In vitro investigations on cell lines or tissue preparations provide results on binding kinetics and affinity to appropriate target structures (receptors, enzymes, ion channels) but also on tissue uptake as well as on physiological changes including cell toxicity. Further preclinical studies are carried out in vivo in small animals (e.g. mouse or rat). The quantitative uptake of a radioconjugate is determined by biodistribution, whereby also the dosimetry can be estimated. Blood and various tissues are examined for metabolites. The accumulation oft he radioligand in the organs of interest is determined by means of small animal imaging (PET, SPECT). Based on the standardized establishment of different Cetuximab (anti-EGFR antibody) conjugates, the preclinical characterization of anti-PSCA (prostate stem cell antigen) antibody conjugates is also to be carried out. This will take place in close collaboration with the Departments for Chemical Biology, headed by Prof. Jens Pietzsch, as well as for Radioimmunology, headed by Prof. Michael Bachmann. Radiokonjugate sind große Moleküle (Antikörper, Antikörperfragmente, Nukleinsäuren, Peptide), die über angeknüpfte funktionale Moleküle (bifunktionale Chelatoren) mit einem entsprechenden Radionuklid markiert sind. Einerseits werden für diagnostische Zwecke, Bildgebung mittels PET oder SPECT, kurzlebige Radionuklide) genutzt, andererseits können für therapeutische Anwendungen auch längerlebige zum Einsatz kommen.
- F. Gao, W. Sihver, C. Jurischka, R. Bergmann, C. Haase-Kohn, B. Mosch, J. Steinbach, D. Carta, C. Bolzati, A. Calderan, J. Pietzsch, et al. Amino Acids 2016, 48, 833 - M. Saki, M. Toulany, W. Sihver, M. Zenker, J. M. Heldt, B. Mosch, H.-J. Pietzsch, M. Baumann, J. Steinbach, H. P. Rodemann. Strahlenther. Onkol. 2012, 188, 823
|
|
|
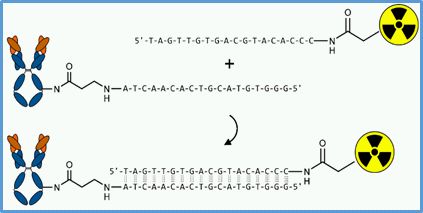
In vivo Demonstration of a Tumor Pretargeting Approach
The large size of full antibodies causes their poor pharmacokinetics, extended blood retention, nonspecific tissue accumulations with respect to the elimination pathways. Thus, radiolabeled antibodies induce a high percentage of radiation dose that is not deposited to the tumor but causing high radiation burden at critical organs. Therefore, an effective and highly specific molecular delivery system for cytotoxic radionuclides is required to achieve therapeutic doses to antibody-pretargeted tumor cells with minimal radiation exposure to non-targeted tissue. This can be done by separation of the targeting and the radiolabeling processes in vivo. Inspired by the efficient recognizing and fast hybridization process of natural complementary nucleic acids, our focus is directed on the use of oligomeric peptide nucleic acids (PNAs) or mirror image L-configured DNA oligonucleotides (L-ONs) that have been demonstrated to be perfect bioorthogonal mimics of natural oligonucleotides. We could establish a successful method to conjugate the antibody cetuximab with different numbers of PNA or L-ON melecules. In two proof-of-principle studies PNAs and L-ONs confirmed their high potential for the use as an in vivo recognition system in pretargeting approaches. The project will be continued using an antibody to the PSCA (prostate stem cell antigen) in collaboration with the Department of Radioimmunology, headed by Prof. Michael Bachmann (link). It is proposed that this method will become a versatile diagnostic and/or therapeutic tool in clinics with a broad range of applications.
- A. Leonidova, C. Foerster, M. Schubert, K. Zarschler, H.-J. Pietzsch, J. Steinbach, R. Bergmann, N. Metzler-Nolte, H. Stephan, G. Gasser. Chem. Sci. 2015, 6, 5601 - M. Patra, K. Zarschler, H.-J. Pietzsch, H. Stephan, G. Gasser. Chem. Soc. Rev. 2016, 45, 6415. - M. Schubert, C. Foerster, R. Bergmann, W. Sihver, S. Vonhoff, S. Klussmann, L. Bethge, M. Walther, J. Pietzsch, J. Steinbach, et al. Bioconjugate Chem. 2017, 28, 1176 |
Principle of using oligomeric PNAs or mirror-imaged L-ONs for tumor pretargeting |
|
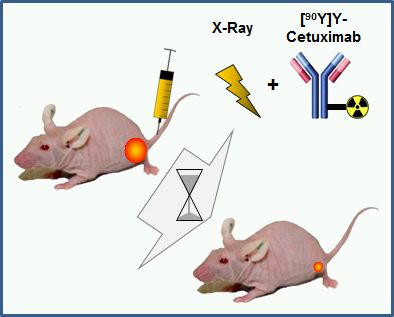
Combination of Internal (Particles) and External (Photons, Particles) Radiotherapy
The combination of internal and external radiotherapy (CIERT) is a promising treatment strategy as it potentially combines advantages of both modalities without increasing toxicity. In close collaboration with the Institute of Radiooncology – OncoRay, led by Prof. Mechthild Krause it was shown that CIERT using 90Y-labeled-cetuximab massively increased tumor control probability of a head and neck tumor model (FaDu xenografts) compared to a single dose of external or internal radiotherapy alone. Further preclinical studies need to include the evaluation of different radiotracers, in particular with shorter penetration depth to preserve more of the healthy tissue. An essential prerequisite of these investigations was the comprehensive (radio)chemical characterization of the (radiolabeled) antibody-chelator conjugates. This included the development of protocols which allow the labeling of the antibody with exactly defined amounts of activity. - L. Koi, R. Bergmann, K. Brüchner, H.-J. Pietzsch, M. Krause, J. Steinbach, D. Zips, M. Baumann. Radiother. Oncol. 2014, 110, 362 - W. Sihver, J. Pietzsch, M. Krause, M. Baumann, J. Steinbach, H.-J. Pietzsch. Pharmaceuticals 2014, 7, 311 - A. Dietrich, L. Koi, K. Zöphel, W. Sihver, J. Kotzerke, M. Baumann, M. Krause. Brit. J. Radiol. 2015, 88, 20150042
|
|
Group Members
Dr. Wiebke Sihver (head of the group)
Anne-Kathrin Nitt-Weber (technical assistant)